2019年底,武汉出现了由新型冠状病毒感染引起的肺炎疫情。截至3月7日,已有80,000多人被感染,3,000多人死亡。
疫情爆发后,几家体外诊断公司声称已经开发出诊断新皇冠流行病的试剂盒。暴发初期,由于聚合酶链反应检测试剂盒供应不足,检测能力不足,湖北仍有疑似病例,但难以确诊。一些病人被告知暂时不能进行病毒检测,于是回家隔离自己。
随着越来越多的体外诊断公司开始提供核酸试剂盒,大量疑似病例已被确诊,但与此同时,新冠状肺炎假阴性核酸检测的问题也开始引起讨论。
此外,由于试剂盒的质量、能够进行临床试验的P3实验室(生物安全3级实验室)的数量、P3实验室设备的准确性和稳定性以及能够进行熟练和稳定操作的医务人员的数量等因素,核酸检测方法的应用受到限制。事实上,面对疫情的爆发,需要多种快速、灵敏、简单、低成本的检测方法来解决假阴性和单一核酸检测方法应用受限的问题。
与核酸诊断相比,免疫诊断是一种基于抗原和抗体之间的特异性免疫反应来检测各种疾病的方法。根据不同的标记信号,推导出不同的免疫诊断方法。就实验室要求而言,与核酸检测相比,抗体检测对临床实验室的操作要求更低,可以快速和大量检测,并且可以在初级实验室中完成。
免疫诊断和核酸诊断的最大区别在于核酸检测是检测COVID-19的特异性核酸。技术原理是先将新的冠状病毒核糖核酸转化为脱氧核糖核酸,然后在检测前扩增样品中的特定核酸序列。
免疫检测通过抗体与抗原的特异性反应原理,通过体内病毒蛋白(抗原)或体内病毒蛋白特异性抗体的检测,广泛应用于艾滋病病毒、乙型肝炎、丙型肝炎等重大传染病的检测。
检测病毒蛋白通常有两种方法:一种是用抗体检测抗原,这是找到被检测抗原必须被感染的直接证据;另一种是用抗原(通常是重组的)来测量抗体。这是间接证据。如果一个人有这种抗体,但没有通过疫苗接种获得,他或她将间接被证明感染了这种病原体。抗体是人体感染病毒后体液免疫反应的产物。
然而,值得一提的是,检测和核酸检测并不冲突,也不能相互替代。它们都是诊断病毒感染的重要手段。
特异性抗体的阳性检测不能像病毒核酸的阳性检测一样被视为病毒感染的“金标准”。早期患者抗体浓度低,甚至不产生免疫反应,这受到检测窗期的限制。同时,因为抗体检测由于存在一些干扰物质(如类风湿因子、非特异性IgM、溶血引起的高浓度血红蛋白等)而容易产生“假阳性”结果。)在血液样本中,抗体检测必须采用同时检测IgM和IgG,并且通常需要多次动态测试来确认。
开发基于病毒蛋白的免疫检测方案的困难在于抗体原料的生产。与核酸检测试剂盒相比,免疫检测试剂盒需要更长的开发时间和更高的生产成本。
从适用场景来看,抗体检测检测速度快,操作简单,对疑似患者的快速检测和调查具有重要意义。更适合基层医疗机构、社区和乡镇卫生院发热人群的筛查,对有效控制COVID-19大规模传播具有重要意义。
与核酸诊断相比,本发明还可以快速筛查无症状病毒携带者,可用于机场、车站、码头等大流量公共场所的分布式筛查,为疫情综合防控和深入调查提供技术支持。
据动脉网络统计,已有20多家企业投资研发新型冠状病毒(COVID-19)免疫诊断试剂。
2月22日,国家药品监督管理局紧急批准了三家企业的三种新型冠状病毒检测产品,包括两种胶体金抗体检测试剂和一种恒温扩增芯片核酸检测试剂,拓展了新型冠状病毒的检测方法和手段,充分服务于疫情防控的需要。这也是免疫诊断试剂首次获准上市并投入一线抗疫线。
据报道,两种被批准的胶体金抗体检测试剂分别来自万福生物和英诺。
接下来,3月1日,国家药品监督管理局向社会发布公告,紧急批准通过了三家企业的四种新型冠状病毒检测产品,包括两种化学发光抗体检测试剂和两种荧光聚合酶链反应核酸检测试剂。
在3月1日的紧急审批中,Bosses(重庆)生物有限公司的新型冠状病毒(2019-nCoV)IgM抗体检测试剂盒(磁性粒子化学发光法)和新型冠状病毒(2019-nCoV)IgG抗体检测试剂盒(磁性粒子化学发光法)产品获得批准。
3月6日,国家药品监督管理局紧急批准厦门万泰凯瑞生物技术有限公司生产的新型冠状病毒(2019-nCoV)抗体检测试剂盒(化学发光微粒免疫分析)
迄今为止,共有10家新的冠状病毒核酸检测试剂制造商和4种抗体检测试剂获得批准。经批准的抗体试剂制造商包括万福生物、英诺特、俄罗斯(重庆)生物有限公司和泰克卡里生物。
免疫诊断方法主要有放射免疫分析法、免疫胶体金法、酶联免疫吸附法、时间分辨荧光免疫分析法和化学发光免疫分析法。动脉网络组织根据不同的方法开发产品的企业。[分区][/分区]
胶体金免疫分析试剂
嗜热生物[分区][/分区]新型冠状病毒(2019-inCoV)lgM/lgG抗体检测试剂盒
2020年1月30日,Hotshot Biology成功开发了一种针对新型冠状病毒的快速免疫试剂和酶免疫试剂。
为应对新型冠状病毒疫情,Hotshot生物“实验室”于2020年1月15日开始研发,1月20日完成核酸试剂研发,1月21日开始基因重组蛋白表达,2月22日开始免疫试剂研发,1月30日先后研发快速免疫试剂和酶免疫试剂。现在,已经为这种病毒开发了三种检测试剂盒。目前,市场上新型冠状病毒感染的诊断方法是病毒核酸检测,需要在专业的聚合酶链反应实验室进行,平均检测时间为120分钟。因此,疫情的预防和控制迫切需要一种快速、简便的诊断试剂盒来筛查新型冠状病毒感染者。
高温生物成功克隆了新型冠状病毒的外膜蛋白。该病毒的蛋白作为免疫诊断的抗原,研制出胶体金免疫检测试剂和上转换发光免疫检测试剂,可在15分钟内快速产生诊断结果。
朱莉试剂新型冠状病毒抗体检测试剂盒
2月13日晚,朱莉集团宣布,中国科学院武汉病毒研究所研制的朱莉试剂和新型冠状病毒抗体检测试剂(胶体金法)和新型冠状病毒抗体检测试剂(胶体金法)已通过体外诊断试剂紧急审批批复,并于2月11日进入快速审批通道。
与此同时,科技部药品检验所、中国科学院武汉病毒研究所和朱莉试剂联合申报的应急项目,以及新型冠状病毒IgM抗体检测试剂盒(酶联免疫吸附试验)也于2月11日进入国家应急审批渠道。
麦坎生物新冠状病毒蛋白检测试剂盒
Mercan Biology开发的新型冠状病毒蛋白快速检测试剂盒采用免疫层析技术,是一种针对POCT的快速检测方法。该方法是将分别标记在纳米粒子上并固定在硝酸纤维素膜检测区的特异性抗体与样品中的新型冠状病毒蛋白抗原形成双抗体夹心免疫反应,利用纳米粒子的显色效应,实现特异性新型冠状病毒蛋白的定性检测。本产品主要用于医疗机构对新型冠状病毒的初步快速筛查,最早可在10分钟内获得结果。
南京诺沃泽姆医学[分部][/分部]新型冠状病毒(2019-nCoV) IgG/lgM抗体联合检测试剂盒
诺和锐已成功开发出新型冠状病毒(2019-nCoV)IgG/IgM抗体联合检测试剂盒(胶体金法)、新型冠状病毒(2019-nCoV)IgG/IgM抗体联合检测试剂盒(量子点荧光免疫分析法)和新型冠状病毒IgM和IgG抗体联合检测试剂卡,并已通过江苏省医疗器械注册和检验,目前正在进行试剂盒的临床验证。
本发明可对全血中的阳性患者进行10分钟的筛查,量子点荧光免疫分析联合检测试剂盒可帮助医院和疾病预防控制批量患者进行筛查和诊断;胶体金检测试剂盒适用于许多基层医院的感染筛查,也适用于那些最近刚回到企业工作和学校的人群。
核心超有机体[分区][/分区]新型冠状病毒(2019-nCoV) IgM抗体检测试剂盒
1月29日,核心超生物新型冠状病毒抗体检测试剂盒(胶体金免疫层析)研制成功。
核心超有机体成功开发的POCT快速检测试剂盒,利用免疫胶体金层析技术实现了对人血清、血浆或全血中新型冠状病毒抗体的体外定性检测,加样后15分钟内即可观察到结果。可方便快捷地用于社区卫生服务中心和基层医院感染病毒患者的早期筛查和早期诊断,不仅提高了检测和诊断治疗的及时性,而且有效地防止了大型医院因广大群众密集检查而造成的交叉感染。
同创医学[分科][/分科]新型冠状病毒(2019-nCov)试纸
新型冠状病毒肺炎疫情爆发后,同创医疗与传染病诊疗协同创新中心开展了密切的科研、技术研究和转化合作。利用前期积累的技术储备,研制出一种适合现场筛查的新型冠状病毒试纸。只要将患者咽喉或鼻腔中的唾液或粘膜液收集到提取管中,然后用试纸进行检测,只需10分钟,通过检测线和控制线两栏的显示即可得到阳性或阴性结果。
目前,该成果已进入临床试验阶段,并已在部分定点医院免费投入使用。
康华生物新冠状病毒(2019-nCoV) IgM抗体检测试剂盒
2020年1月31日,潍坊康华生物技术有限公司研制的胶体金法免疫层析新型冠状病毒(2019-nCoV)IgM抗体检测试剂盒通过了国家食品药品监督管理局济南医疗器械质量监督检验中心的检验,成为中国第一个通过法定检验机构检验的新型冠状病毒IgM抗体快速检测产品。目前,它正在向国家食品药品监督管理局申请紧急批准。取得注册证书后,可以投入市场销售。
在获得国家药品监督管理局的列表批准后,快速诊断试剂盒将被送往全国各地的医院,以便在社区卫生服务中心、一级医院、三级医院的门诊和急诊科以及发热门诊对可疑人员进行早期筛查和诊断。这次通过注册测试的两款产品操作简单。样本包括全血、血清和血浆,最早可在3分钟内获得结果。单份测试,不需要仪器设备,适合现场筛选。
浙江东方基因生物学新型冠状病毒抗体检测试剂盒方法
东方基因成功开发了新型冠状病毒核酸检测试剂盒(非提取荧光聚合酶链反应法)和新型冠状病毒抗原检测试剂(胶体金法),并已用于临床试验和科研试验,核酸检测试剂盒的准确率达到97%以上。胶体金法操作简单,可将检测时间缩短至10分钟。
这两种试剂产品已经省级食品药品监督管理局审查和推荐,目前正在向国家食品药品监督管理局申请注册。
凯奇生物[分公司][/分公司]新2019-nCoV免疫诊断试剂盒
2020年2月8日,凯基生物与南京大学联合攻关,加快研制新型冠状病毒免疫诊断试剂盒。该产品是采用高通量纳米抗体筛选技术结合胶体金法开发的新型2019-nCoV免疫诊断试剂盒。
凯吉生物利用免疫学方法开发了10多种检测试剂盒,包括半乳糖凝集素-3检测试剂盒、可溶性生长刺激表达基因2蛋白(ST2)检测试剂盒、D-二聚体检测试剂盒、肌钙蛋白I检测试剂盒等。在免疫技术领域积累了丰富的技术和经验。该试剂盒的研制还利用了南京大学特有的高通量纳米抗体筛选技术,使筛选出的纳米单克隆抗体具有高稳定性(在90℃下不降解)、高亲和力、与人抗体同源性在80%以上、低毒性、低免疫原性,保证了试剂盒的稳定性和准确性。
荧光免疫层析
华克泰生物新冠状病毒(2019-nCov)抗原检测试剂
华科泰拥有成熟的POCT技术平台,希望利用这项技术为抗击疫情贡献自己的力量。春节期间,华科泰R&D团队通过技术研究,利用荧光微球免疫层析技术,成功开发了2019-nCoV新型冠状病毒POCT快速免疫检测试剂盒,并先后尝试了20对抗体和数百个技术方案。取咽拭子作为检测样本,直接检测新的冠状病毒抗原,结果在15分钟内获得,充分支持疫情检测。
华科泰成立于2007年,已经完成了第三轮融资。
万福贝特2019-nCoV新型冠状病毒抗原/(抗体)检测试剂2019-nCoV新型冠状病毒IgM抗体检测试剂
2020年1月20日,万福生物的子公司万福贝特公司宣布成功开发出一种新型冠状病毒呼吸道病原体多核酸检测卡。检测组合是根据国家卫生保健委员会办公厅发布的《新型冠状病毒肺炎诊疗方案(试行2版)》的指导,包括新型冠状病毒和其他需要鉴别诊断的呼吸道病原体,结合万福贝特专利的BoxArray (Bocos Rui)全自动多核酸检测平台,建立新型冠状病毒呼吸道病原体全自动全封闭式多核酸检测模式。
免疫层析
MEK医学新冠状病毒(2019-inCoV)抗体检测试剂盒
默克医疗公司立即召集了一个技术团队来组织新冠状病毒肺炎检测技术的研究工作。该团队以感染新冠状病毒的患者体内产生的IgM/IgG抗体为目标,开发了一种检测试剂盒,可以在15分钟内快速产生结果。结合其他临床适应症,该系列免疫试剂可快速、有效、定性地进行医院临床诊断。
微流控时间分辨荧光免疫分析
成都维康生物[分公司][/分公司]新型冠状病毒(2019-nCoV)IgM、lgG抗体检测试剂盒
疫情爆发后,成都微生物与华西医院联合,基于微流控POCT诊断平台,通过自主研发新型冠状病毒特异性表位抗原和抗体,结合共聚焦时间分辨荧光免疫分析和微流控时间分辨荧光免疫分析技术,开发了检测系统。将血液用作样品,并在15分钟内获得结果。检测灵敏度高达1毫克/毫升,变异系数仅为5%左右。采用特殊的喷雾冷冻干燥技术,芯片可在室温下储存,适合更多场景。
化学发光
BOOSES新型冠状病毒(2019-nCoV)lgM/lgG抗体检|检测试剂盒
据报道,重庆医科大学与博斯生物技术有限公司合作,成功研制出新型冠状病毒(2019-nCoV)化学发光免疫试剂盒,该试剂盒具有检测速度快、通量高、成本低的特点,可用于新发冠状病毒肺炎的早期诊断、流行病学筛查和临床预后预测。重庆医科大学附属永川医院、重庆三峡中心医院和市公共卫生医疗中心(均为重庆市指定的重点医疗机构)合作完成了200例试剂盒的临床验证。
增城生物新冠状病毒(2019-inCoV)抗体诊断试剂盒
新型冠状病毒疫情爆发后,泽成生物迅速启动了新型冠状病毒中2019-nCoV免疫检测试剂盒的相关研究工作,并在短时间内快速完成了2019-nCoV的IgG和IgM血清学诊断试剂盒(化学发光法)的研发。
新工业生物学新冠状病毒2019-nCovlgG抗体,lgM抗体检测试剂盒
2017年7月,这种新型工业生物成为中国第一家获得美国食品和药物管理局批准的化学发光制造商。2018年,这种新型工业生物成功发布了全球最快的全自动化学发光免疫分析系统MAGLUMIX8。
新工业生物公司试剂开发了全自动化学发光新型冠状病毒2019-nCoV抗体和新型冠状病毒2019-nCoV抗体检测试剂盒。
本发明的新型工业生物新型冠状病毒检测试剂盒最早可在25分钟内获得第一个检测结果,每小时可进行300次检测,全天24小时全自动连续检测,使用血样,方便采集,协助筛查可疑病例。
苏会龙生物[分部][/分部]新型冠状病毒(2019-nCoV)抗原、IgM、lgG抗体检测试剂
叶海龙首先建立了一组抗原和抗体检测试剂。自疫情爆发以来,亚回龙的研究人员已经攻克了病毒特异性蛋白的基因工程表达、纯化和大规模生产,并完成了检测新型冠状病毒(2019-nCoV)抗原、IgM抗体和IgG抗体的系列产品的开发。
天神医学[分部][/分部]化学发光新型冠状病毒抗体检测试剂盒
2020年2月4日,深圳市天神医疗器械有限公司宣布与深圳市第三人民医院(国家传染病临床研究中心)和深圳大学联合研制成功2019年新型冠状病毒IgM和IgG抗体检测试剂盒(化学发光法)。
目前,该试剂盒正在深圳市第三人民医院(国家传染病临床研究中心)进行临床试验。初步临床实验表明,发热7-14天患者临床标本中,IgM和IgG的临床符合率分别为96.6%(29/30)和96.6%(29/30)。同时,该公司也在验证更大的临床样本。相关工具包的登记和认证正在进行中。[分区][/分区]
COVID-19免疫诊断试剂成功制造商列表
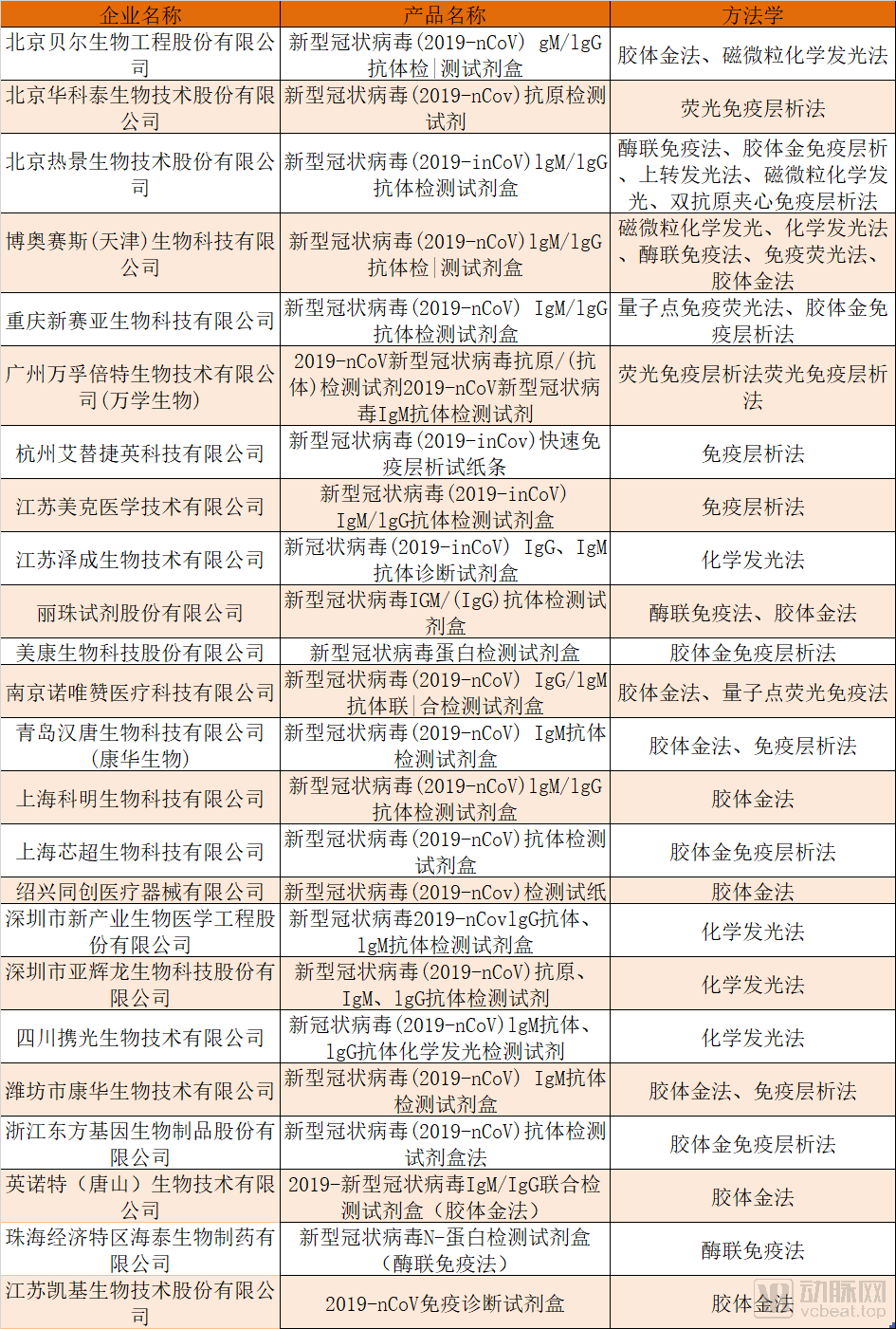
[分区][/分区][分区][/分区]*如果企业不包括在此表中,也可以联系动脉网络一起讨论。
抗体制备和冷链运输变得困难
对于新的冠状病毒,由于最初的研究,通常很难快速制备抗体。
成都微健康生物技术有限公司创始人兼首席执行官唐勇博士告诉动脉网络:“研发新型冠状病毒快速免疫检测试剂的关键难点在于寻找病毒特异性抗原和高特异性表位抗体。目前,大多数已完成的免疫检测试剂盒都是基于常规冠状病毒抗原,缺乏特异性,容易造成误诊和漏诊。”
此外,他还指出,停滞不前的物流也将给基层免疫诊断产品带来挑战。他说:“目前,大多数免疫诊断试剂需要冷链运输。疫情爆发后,物流和冷链基本停滞,基层医院冷链运输更加不可能,试剂性能也无法保证。然而,在短时间内,许多公司无法改变试剂的形式和储存方法。”
核酸检测中的漏诊也可能发生在免疫诊断中。由于目前新的冠状病毒IgM或IgG胶体金检测试剂灵敏度低且假阴性,很容易造成漏诊。同时,由于大多数胶体金试验选择了N蛋白作为检测目标,但N蛋白与其他冠状病毒有很高的同源性,且特异性低,容易造成假阳性,导致漏诊。
目前,从审批情况来看,已有四种免疫诊断试剂获准上市。
天神医疗集团董事长姚天成告诉动脉网络:“正常审批需要3年,紧急审批需要1-2个月。但是,审批中的影响因素需要考虑企业的产品在紧急审批后能否快速、大规模、有效地应用于防疫。具体条件需参照国家食品药品监督管理局的要求。”
2020年2月12日,国家药品监督管理局医疗器械技术评估中心发布了《2019年新型冠状病毒核酸检测试剂注册技术评估要点》,但至今尚未发布抗原/抗体检测试剂评估要点的相关信息。
在2003年非典疫情期间,军事医学科学院、中国科学院北京基因组研究所、华大基因等单位开发了酶联免疫试剂盒,可以检测非典病毒本身或患者对病毒的免疫反应。在这场疫情中,许多企业的产品也进入了审批渠道。我们希望随着一批免疫检测产品的上市,疫情防控单位能够快速筛查感染者和潜在感染者,了解疫情。
发布时间:2020-03-09 10:32